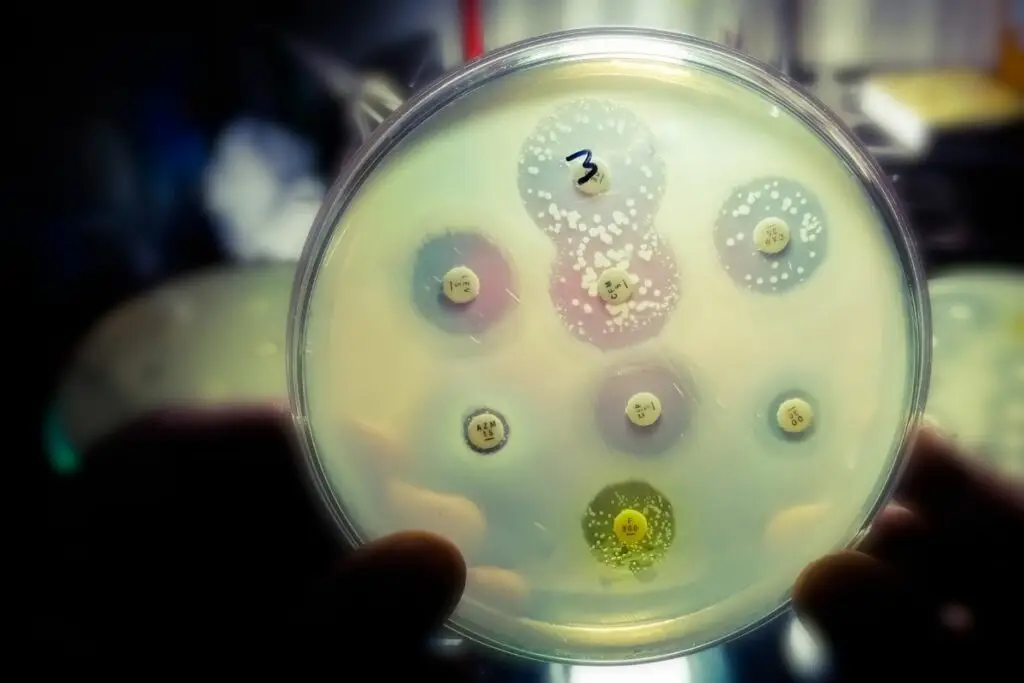
Une boîte de Petri géante de 60 cm sur 1,20 m, remplie de 14 litres d’agar-agar – le substrat nécessaire à la prolifération d’Escherichia coli –, et une caméra pointée sur ce montage. Avec un bon éclairage, c’est tout ce dont des chercheurs de Harvard ont eu besoin pour montrer l’irrésistible ascension des résistances bactériennes.
« L’émergence puis la diffusion des EPC risquent ainsi de conduire à de véritables impasses thérapeutiques. » Rapport 2016 Anses/ANSM/SPF
De chaque côté de ce champ de bataille microscopique, une zone sans antibiotique, puis, en se rapprochant du centre, la zone suivante contenait la dose tout juste suffisante de triméthoprime pour éliminer E. coli, puis 10 fois la dose initiale, 100 fois la dose… et enfin 1 000 fois au centre de l’installation. À votre avis, combien de temps aura-t-il fallu à E. coli pour arriver au centre et former des colonies dans ce milieu ultra-hostile en temps normal ? À peine dix jours. Filmé, accéléré et condensé dans une vidéo d’à peine deux minutes (voir « Pour aller plus loin », ci-dessous), le processus est glaçant… même si les chercheurs sont les premiers à reconnaître qu’il ne reproduit pas les conditions réelles de développement des résistances dans la nature où les bactéries sont confrontées à de nombreux organismes et molécules. La réalité est donc beaucoup plus complexe, mais parfois tout aussi inquiétante.
Transmission éclair
Un vent de panique a soufflé en 2015 : la colistine, un vieil antibiotique polypeptidique de la famille des polymyxines découvert dans les années 1950 et longtemps délaissé à cause de ses effets toxiques sur le rein mais largement utilisé chez les animaux, était en danger. Les scientifiques considéraient en effet que la résistance à cette molécule ne pouvait se transmettre entre micro-organismes. C’était la raison principale pour laquelle elle était considérée comme le dernier barrage contre nombre de bactéries résistantes aux céphalosporines de dernière génération et aux carbapénèmes.
Mais en novembre 2015, un article publié dans The Lancet décrivait le premier cas de transmission bactérie à bactérie de cette « compétence », via un gène appelé MCR-1, détecté chez des porcs et des poulets dans des élevages en Chine. « La vitesse à laquelle les bactéries ont acquis la résistance constitue l’aspect le plus alarmant de cette dernière découverte. Une seule interaction entre des bactéries résistantes et non résistantes peut dès lors donner deux organismes résistants […]. Il ne s’agit pas là du lent glissement de changements accumulés mais du transfert, en un seul coup, de tout l’ensemble de gènes requis pour cette opération », estimait Michael Loughlin, maître de conférences à la Nottingham Trent University sur le site Theconversation.com en décembre 2015. À tel point que nombre de chercheurs appelaient déjà le grand public à imaginer un monde sans antibiotiques. Heureusement, les outils de séquençage génétique aidant, la prise de conscience a été quasi instantanée et s’est faite à l’échelon mondial, remarquait le chercheur danois Robert Skov dans le journal Eurosurveillance en mars dernier : « en à peine trois mois à partir de la description du premier cas, nous avons appris que le gène MCR-1 était disséminé sur la plupart des continents » et dans des substrats très divers, comme les rivières, la viande de différents animaux, chez des voyageurs à l’international… Les premiers cas français ont été documentés en juillet 2016 par le Haut Comité de la santé publique (deux en Nouvelle-Calédonie, un à Angers, un à Marseille) : « Ces quatre patients [infectés par des souches d’entérobactéries porteuses du gène MCR-1, NDLR] ont été isolés lors de leur hospitalisation, mis en précautions complémentaires contacts [ports de gants, tablier… par le personnel de soins, NDLR] et les patients contacts autour de ces cas ont été dépistés. Aucun cas secondaire n’a été identifié autour de ces patients. » Heureusement pour ceux qui étaient atteints, les infections qui en ont résulté étaient asymptomatiques. Ce n’est pas tout : le MCR-1 a également été isolé en janvier 2016 dans des élevages sur des souches de Salmonella et E. coli.
La peur des impasses
En 2016, mourir d’une égratignure infectée ? Dans un monde où les antibiotiques deviendraient massivement inefficaces, l’apocalypse serait à nos portes. Ce n’est pas la première frayeur largement médiatisée autour de ces superbugs, comme les appellent les Anglo-Saxons, des micro-organismes capables de forcer toutes les lignes de défense thérapeutique, y compris dans les forteresses sanitaires des pays industrialisés. Les premières d’entre ces bactéries multirésistantes (BMR) aux antibiotiques sont nées dans les années 1970 avant de se diversifier dans les années 1980 – avec l’apparition des premières résistances aux céphalosporines de troisième génération –, puis de se diffuser dans les années 1990 et de céder la place, dans les années 2000, à leurs petites sœurs : les bactéries hautement résistantes émergentes (BHRe), un terme apparu au début de cette période, qui ne colle à aucune définition précise mais désigne, entre autres, les entérobactéries productrices de carbapénémase (EPC) qui sont, avec les souches porteuses de résistance à la colistine, au centre de toutes les inquiétudes aujourd’hui car constituant de potentielles impasses thérapeutiques. Au risque d’une certaine surenchère. En d’autres termes : joue-t-on à se faire peur ?
Gavés d’antibios
« En à peine trois mois à partir de la description du premier cas, nous avons appris que le gène MCR-1 était disséminé sur la plupart des continents. »
Robert Skov, Statens Serum Institut
La dernière Journée européenne d’information sur les antibiotiques, le 18 novembre, a été l’occasion, pour les trois agences gouvernementales – Santé publique France (SPF), Agence nationale de sécurité du médicament (ANSM), Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses) – chargées de surveiller et encadrer la consommation et l’utilisation des antibiotiques dans l’Hexagone, de produire un bilan commun des résistances en ville, à l’hôpital mais aussi chez l’animal. Une première, instructive à plusieurs niveaux. Tout d’abord, sur la consommation, la France fait toujours preuve d’une gourmandise coupable : elle se place sur le podium européen des plus gros utilisateurs d’antibiotiques, derrière la Grèce et la Roumanie. En ville, leur « consommation s’inscrit à la hausse passant de 28,9 doses en 2005 à 29,9 doses en 2015 », là où plus de 90 % des antibiotiques sont prescrits, avec une domination écrasante de l’amoxicilline associée ou non à l’acide clavulanique, qui représente à lui seul 37,6 % des antibiotiques… et dont la consommation ne baisse pas, contrairement aux autres classes ! À l’opposé, l’hôpital fait preuve de plus de modération, avec 2,2 doses en 2015 contre 2,4 en 2005. Du côté de nos amis à quatre pattes, la triple alliance des agences se félicite d’un allègement notable de la consommation avec une « exposition globale des animaux aux antibiotiques [en diminution] de 20 % » entre 2011 – l’année de référence du plan Écoantibio – et 2015.
Qui a laissé sortir la Klebs ?
Côté résistance, la France a engrangé quelques succès, même si nous restons un des hauts lieux européens des résistances bactériennes. En ville, le taux de résistance des Sarm (staphylocoques dorés résistants à la méticilline) est stable, autour de 17 % en 2013, et la résistance à la pénicilline et aux macrolides chez le pneumocoque a presque été divisée par deux en dix ans. Une bonne nouvelle due au développement de la vaccination antipneumococcique (Pneumo23 et Prevenar), dont la couverture est excellente, avec 96,9 % des enfants nés en 2015 ayant reçu une dose.

Cela va néanmoins moins bien du côté de E. coli, dont les résistances aux céphalosporines de troisième génération sont passées de 1 à 4 % entre 2005 et 2013. Les trois agences mettent d’autre part particulièrement en lumière les résistances plasmidiques à la colistine et les fameuses EPC, estimant que « l’émergence puis la diffusion [de ces dernières] risquent de conduire à de véritables impasses thérapeutiques, pouvant à terme mettre en péril les grandes avancées de la médecine moderne ». Rien de moins. Côté chiffres, « au 31 décembre 2015, 2 385 épisodes à EPC ont été signalés à l’Institut de veille sanitaire (INVS) et concernent un total de 4 073 patients », signalent les trois agences, en rappelant toutefois que la grande majorité des patients a été colonisée mais ne présente pas d’infections, ce qui est un signe encourageant pour la qualité des dépistages mis en place. La principale coupable est Klebsiella pneumoniae. Il n’y a néanmoins pas que des raisons de se réjouir : si la situation est contrôlée en France – avec moins de 1 % de K. pneumoniae résistante –, certains pays du sud de l’Europe ont des taux trente fois plus élevés. Or cette catégorie de bactéries à Gram négatif est précisément celle qui pose le plus de problèmes : peu de molécules sont disponibles pour les contrer et la recherche patine dans ce domaine.
Du côté des tuyaux
Tous les regards sont donc braqués vers les pipelines des industriels du médicament, notoirement vides depuis des dizaines d’années en ce qui concerne les antibiotiques, des molécules très largement génériquées. Il faut dire que, dans ce domaine, la recherche nécessite, en plus de moyens considérables, pas mal d’imagination (voir encadrés « Vous avez dit éligobiotique ? », et « Des antibiotiques sous nos pieds » ci-dessous) et un peu de culot pour se tourner vers des approches non traditionnelles. « Beaucoup de firmes pharmaceutiques majeures se sont retirées de la recherche sur les antibiotiques, certes, mais pas toutes [comme GSK ou AstraZeneca, NDLR]. Et parmi ces dernières, peu ont fait des progrès. La combinaison de ces deux paramètres a tiré le champ de recherche vers le bas », analyse Derek Lowe sur son blog In the pipeline, hébergé par la revue Science.
Il croit pourtant à l’avenir des antibiotiques, y compris financièrement : « si vous alliez voir une firme en lui proposant des molécules comme le linézolide ou la ciprofloxacine avec le marché potentiel qu’elles avaient au moment de leur sortie, elle signerait tout de suite », assure-t-il. Pourtant, aucune classe d’antibiotiques n’a été découverte depuis 1984, selon The Pew Charitable Trusts, une organisation non gouvernementale, qui a produit un rapport en mai dernier sur le sujet (voir « Pour aller plus loin », ci-dessous).
En attendant de trouver la solution miracle, les pipelines des laboratoires commencent néanmoins à se remplir de solutions alternatives, que ce soit des anticorps contre les bactériémies à Staphylococcus aureus (comme le 514G3 chez XBiotech) ou contre les pneumonies à Staphylococcus aureus (MEDI4893 Medimmune), mais aussi des probiotiques contre les infections à Clostridium difficile (VP20621 chez Shire) ou tout simplement des vaccins, comme Cdiffense, actuellement en phase 3 chez Sanofi Pasteur. Il ne reste donc plus qu’à espérer que les chercheurs et l’industrie remportent la course contre la montre car, comme le rappelle The Pew Charitable Trusts, « réduire les utilisations inappropriées ralentira le développement des résistances mais elle ne les arrêtera pas. L’efficacité des antibiotiques existants continuera de diminuer avec le temps ». Avec 23 000 morts par an dues à l’antibiorésistance outre-Atlantique et 12 500 dans l’Hexagone, il semble plus que temps de prendre le problème à bras-le-corps.